DNA Dizi Analizinde Geleneksel Yöntemler
DNA dizi analizleri ya da sekanslama DNA birincil yapılarının tayininde ve nükleotid baz dizilimlerinin belirlenmesinde kullanılan yöntemdir.
İlk yöntemler, proteinlerdeki aminoasit dizilerinin saptanmasına dayanmaktadır. İlk dizi analizi, 1960’ların başında 75-80 nükleotidi kapsayan küçük tRNA’lar ile başlamıştır. Maya alanine tRNA molekülünün 1964’de dizi analizinin yapılması ile moleküler biyolojide önemli bir adım atılmıştır.
DNA Dizileme;
- Gen yapısı ve genetik kontrol mekanizmaları hakkında çok sayıda bilgi edinmemizi sağlamıştır.
- Özellikle kalıtsal hastalıkların meydana gelme ve tedavi süreçleriyle ilgili mekanizmaların anlaşılması için, araştırma yapılan konuya etki eden gen bölgelerinin belirlenmesi gerekir. Bu nedenle DNA dizileme yapılması, tedavi sürecinin başlangıcı ve devamında izlenecek yolu belirleyen en önemli faktördür.
- DNA dizileme yöntemi ile birçok canlı türünün tüm genom haritaları tanımlanmıştır.
- Sıklıkla gen mutasyonları (delesyon, inversiyon vb.) tespiti ya da rekombinant DNA oluşum yapılarının tayininde kullanılır.
- Preimplantasyon tanısı, kalıtsal hastalık tayininde sıklıkla kullanılmaktadır.
- Kalıtsal hastalık taşıyan çiftlerde tüp bebek embriyolarından alınan DNA’lar bu yöntemle analiz edilerek taşıyıcı embriyolar elenip, genetik hastalık taşımayanların doğması sağlanmaktadır.
Dna Dizileme Yöntemleri
- Sanger Dideoksi Yöntemi
- Maxam-Gillbert Kimyasal Degredasyon Yöntemi
Her iki teknikte 3 temel basamaktan oluşmaktadır;
- DNA’nın hazırlanması
- Reaksiyonlar
- Yüksek voltajlı jel elektroforezi
Her iki analiz sırasında da tek iplikçikli DNA parçaları hazırlanıp DNA dizi analiz yöntemi sırasındaki temel fark DNA fragmentlerinin üretilme biçiminden kaynaklanmaktadır. Jel elektroforezi yüksek çözünürlükteki DNA moleküllerini ayrıştırdığı için her iki metod içinde kullanılmaktadır.
- Sanger Dizi Analiz Yöntemi;
- Dideoksi yada zincir sonlandırma reaksiyonu olarak da bilinmektedir.
- Bu yöntem için;
- Tek iplikli kalıp DNA’ya
- dNTP’lere
- ddNTP’lere
- DNA Polimeraz
- Serbest OH grubu içeren primere ihtiyaç vardır
ddNTP’ler dideoksinükleosittrifosfatlardır. OH grubu taşımayan modifiyenükleotit substratlardır. Bunlar riboz şekerinin ikinci karbon atomuna ek olarak üçüncü karbon atomunda da deoksi halde olduğundan fosfodiester bağının oluşumu engellenir ve yeni nükleotidler yapıya katılmaz. DNA zincir uzaması sonlanır. Bu Sanger yönteminin en önemli noktasıdır.
Öncelikle analiz için kullanılacak olan kalıp DNA asimetrik amplifikasyon yöntemi ile hazırlanır. Böylelikle daha fazla kalıp DNA elde edilmiş olur. Bu amaçla dizi analizinin yapılacağı kolun primer derişimi komplementer kolundakinden daha yüksek tutulur. Döngü ilerlediğinde ise sınırlayıcı primerin bittiği anda yalnızca uzama kolu çoğalır. Amplifikasyon bitiminde ürün ortamındaki maddelerden arındırılır. Artık tek zincirli kalıp DNA olarak kullanılmaya hazır olmuş olur.
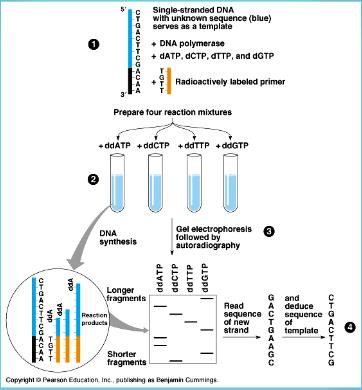
İlk olarak reaksiyon sonunda oluşacak ürünlerin rahat bir şekilde görüntülenebilmesi için DNA molekülü işaretlenir. İşaretleme için genellikle S35, P33 ya da P32 kullanılmaktadır. İşaretleme ya gama pozisyonuna, yapısında bulunduran nükleotidleri kullanarak ya da alfa pozisyonunda işaretli dNTP’leri kullanarak yapılmaktadır. DNA polimeraz, primer kalıp DNA ve dNTP’ler ortama konulup işaretli nükleotidin yapıya katılması sağlanmaktadır. Kullanılan ddNTP’lerin konsantrasyonu diğer maddelerden daha düşük olmalıdır. İşaretleme primere de yapılabilmektedir. İşaretleme sonrası zincir sonlanması reaksiyonları seçilir. Karışım dört kısma ayrılarak dört tüpe konulur. Her tüpe gerekli enzim faktörleri ile birlikte düşük derişimli farklı ddNTP’ler konulur ve inkübe edilir. ddNTP’ler ve dNTP’ler aynı karışıma konduğunda aralarında bir yarış olur substrat olarak dNTP’ler kullanıldığı sürece uzama devam eder. Sentezin herhangi bir noktasında yapıya dideoksi girdiğinde reaksiyon durur. Her tüpte aynı anda birbirinden bağımsız birçok reaksiyon oluşmuştur. Sonuç olarak primer sonundan başlayıp pramtüre sonlanmaların olduğu bölgelere kadar çeşitli uzunlukta DNA parçaları oluşur.
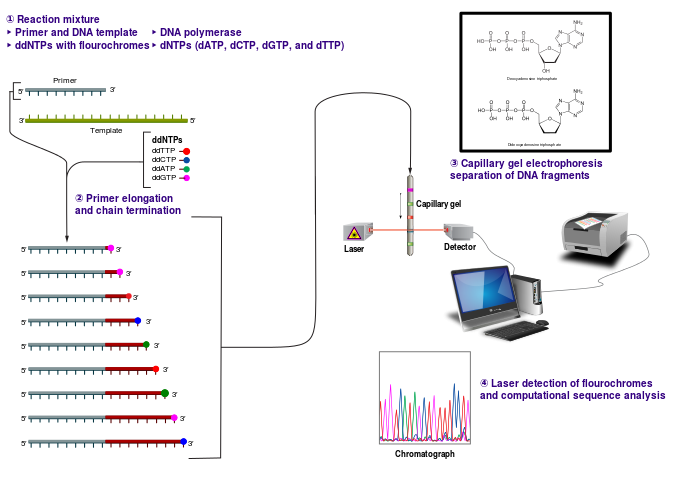
Oluşan ürünlerin ayrıştırılabilmesi için yüksek rezülasyonlu denatüre edici poliakrilamid jel elektroforezi kullanılmaktadır. Elektroforez sonunda jel kurutularak otoradyografi ile fotoğrafı çekilir. Otoradyogramdan elde edilen basamak şeklindeki bantlar radyoaktif izotop taşıyan tek zincirli DNA moleküllerine aittir. Birbirine en yakın iki bant arasında tek bir nükleotitlik fark vardır. Elektroforezde mobilitesi en hızlı olan primere en yakın olandır, yani radyoaktif elemente en yakın bant en küçük DNA fragmentidir. Bu fragmen hangi ddNTP ile oluşturulmuş ise işaretten sonra gelen ilk bazdır. İlk banta en yakın ikinci bazı verir. Böylece aşağıdan yukarı doğru çıktıkça hareketi azalan bantların hangi ddNTp ile oluşturulduğu belirtilir. Sonuç olarak otoradyogramda ki bu bant verilerinden yararlanılarak 53 yönüne doğru olan baz dizilimi saptanmış olur.
Sanger Yönteminde Kullanılan Enzimler;
- Coli Klenow Fragmenti DNA Polimeraz I
- Ters Transkriptaz
- Sequenaz Enzimleri
- Taq DNA Polimeraz
Yöntemin Dezavantajları;
- DNA parçaları dizilemeden önce klonlanmışsa, elde edilen dizide klonlama vektörüne ait kısımlar da olabilir.
- Buna karşın, yeni dizileme teknolojilerinde klonlama vektörü olmaz.
- Uzunluk farkı bir nükleotit olan büyük DNA parçaları için ayrım gücü yetersizdir.
- DNA dizilemesinde ilk 15-40 baz dizisinin kötü kaliteli olması ve 700-900 bazdan sonra dizileme kromatogramının kalitesinin kötüleşmesidir.
DNA Dizi Analizinde Dikkat Edilmesi Gereken Hususlar;
- Asimetrik DNA amplifikasyonunda sınırlayıcı primer 1-2 pmol’dan (10-6) fazla olamamalıdır.
- Amplifikasyon ürünleri temizlenmeden kullanılmamalıdır.
- Kalıp DNA ile primerin birbirine oranı 1 olmalıdır.
- Guanin ve sitozince zengin bölgeler sekanslanırken;
Yüksek annealing sıcaklığı seçilmeli
DNA ve primer birleşmesi oda sıcaklığında en az 20 dakika olmalı
Sequeans yerine taq polimeraz kullanılmalıdır.
- Jelde saf ve kaliteli kimyasallar kullanılmalıdır.
- Eğer radyoaktif işaretleme yapılacaksa yarılanma ömründen dolayı S35 tercih edilmelidir.
- Maxam-Gillbert Yöntemi (Kimyasal Kırılma);
1976-1977’DE Harvard Üniversitesi’nden Allan Maxam ve Walter Gilbert, DNA’nın kimyasal modifikasyonu ve ardından onun spesifik bazlarda kesilmesi esasına dayanan bir DNA dizilime yöntemi geliştirdi.
Farklı uzunluktaki DNA parçalarının oluşumu ile sonlanan DNA’yı kesmek için kimyasalların
( Hidrazin, dimetil sülfat ya da formik asit ) kullanıldığı yöntemdir.
Yöntemin temel prensibi, DNA’da bulunan bazların kimyasallar kullanılarak değiştirilmesine ve daha sonra değişikliğe uğramış nükleotidlerin (piperidin) bulunduğu noktalardan zinciri kırması esasına dayanmaktadır.
Tek bir sekans jelinde 40 klonun analiz edilmesi sağlanır.
Pürinlerin kırılmasında dimetil sülfat kullanılır.
Bazik ortamda DNA guanin bazından kırılırken asidik ortamda DNA adenin bazından kırılır.
Primidin bazlarının kırılması hidrazin ile yapılır.
Hidrazin DNA’yı hem sitozin hem de timin bazından kırar.
Yüksek tuz derişimi ve bazik ortamda DNA sitozin bazından kırılır.
Bu yöntemde nükleotid dizisi saptanacak DNA, önce 5’ ucunda P ile ya da flouresan bir boya ile işaretlenir.
DNA’nın iki iplikçiği birbirinden ayrılarak, ya da DNA uygun bir restriksiyon enzimi ile kesilerek DNA’nın bir ucundan işaretlenmesi sağlanır.
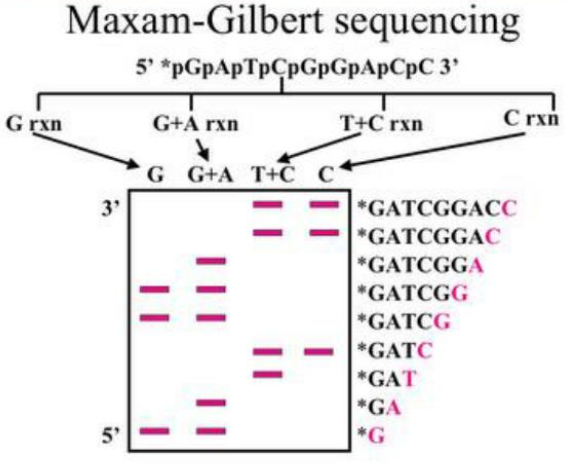
İkinci adımda ise DNA molekülleri dört tüpe ayrılarak A,C,G,T nükleotidlerini kırmak için gerekli tepkimeler gerçekleştirilir.
Elde edilen boyaları gittikçe kısalan DNA dizileri, jel elektroforezi ile birbirlerinden büyüklüklerine göre ayrılır ve otoradyografi uygulanarak bantlar görüntülenir.
Yöntemin Dezavantajları;
- Yöntemin karmaşıklığı
- Biyolojik kitlerle kullanılamaması
- Zararlı kimyasalların kullanılması
- Ölçeklemesinin zor olması
- Yavaş olması
- Büyük genom dizilemeleri için elverişsiz olması
Şevval ÇAKIR;
Kaynaklar;
1.slideserve.com/jael/dna-d-z-leme
2.evrimagaci.org/dna-dizileme-yontemleri-genleri-nasil-diziliyoruz-21
3.personel.klu.edu.tr
4.prezi.com/hivzvaugyxr2/buyuk-olcekli-dna-dizileme-ve-dizileme-metodlarna-genel-bi/
5.yunus.hacettepe.edu.tr/~mergen/derleme/d_dizi.pdf