Kütle Spektrometresi Tabanlı Proteomik Analizlerde Proteinlerin Sindirim Yöntemleri
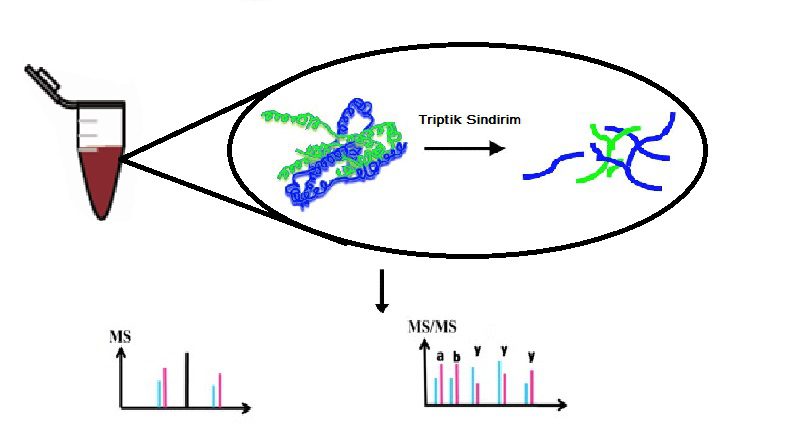
Biyolojik molekülleri tanımlamak ve karakterize etmek için kütle spektrometresinin (MS) kullanımı protein biyokimyası ve proteomik analizin temel bir teknolojisidir. Analizin gerçekleştirileceği seviyeye bağlı olarak (protein veya peptit tanımlama) bir kaç proteomiks yaklaşım mevcuttur. En yaygın olarak kullanılan yöntem proteinlerin geniş bir aralıkta tanımlanmasına olanak sağlayan LC-MS veya MALDI-TOF-MS sistemlerinin kullanıldığı proteinlerin peptitlere sindirildiği bottom-up yaklaşımıdır. Proteinleri hazırlamak için kullanılan stratejiler veya MS analizi için daha karmaşık proteomik numuneler birçok basamak içerir ve bottom-up proteomiklerde protein, MS analizinden önce kimyasal veya enzimatik sindirim yoluyla peptidlere ayrılır. Bu yaklaşımda proteinlerin peptit seviyesine parçalanması bir kaç basamak içerir ve bu nedenle zahmetli bir işlemdir. Bu tür yaklaşımlarda en önemli adım, en zor ve zahmetli aşamalardan olan ve aynı zamanda en çok zaman harcadığımız basamak olan proteinin sindirilmesidir. Bir çok yöntem gece boyu bekleme veya saatlerce bekleme gibi basamaklar içerir. Sindirim süresinde yapılabilecek bir revizyon iş hacminde önemli bir kazanç sağlayacaktır. Araştırmacılar en çok bu noktada yoğunlaşmakta ve en verimli sindirim metodu üzerine çalışmalar yapmaktadır. Teknolojinin gelişmesi bu basamakların da online işlemlere entegrasyonunu mümkün kılmıştır. Böylelikle numune kayıpları ve zaman israfları azaltılarak en ideal yöntemler geliştirilmeye başlanmıştır.
Protein analizi stratejilerinde MS analizinden önce ki başlıca adımlar arasında, sindirim için protein numunesinin hazırlanması, ilgilenilen belirli peptitlerin zenginleştirilmesi ve nihai peptid karışımının temizlenmesi veya tuzdan arındırılması bulunmaktadır. MS seviyesinde başarının anahtarı protein ve peptid seviyesinde örneklerin dikkatli bir şekilde hazırlanmasından geçmektedir. Bu nedenle, dikkatli olunması gereken konu ilgili protein veya proteinlerin maksimum amino asit sekans kapsamını elde etmek için ilgili her adımın optimize edilmesidir.
Proteomik stratejilerde proteinlerin tanımlanmasında uygulanan proteinlerin sindirimi, hem enzimatik hem de enzimatik olmayan karakterizasyon ve kantitasyonda neredeyse vazgeçilmez bir araçtır. Protein parçalanması için klasik yaklaşımlar, proteolitik enzimleri içeren ve çoğunlukla çözelti içinde veya jel içerisinde gerçekleştirilen kimyasalları kullanan enzimatik sindirim ve enzimatik olmayan sindirimdir. Farklı enzimlerin düzenli olarak eklendiği enzimatik sindirim için çeşitli yarılma spesifiteleri ve verimlilikleri olan geniş bir proteolitik enzim aralığı mevcuttur. Kimyasal sindirim esas olarak asitleri ve küçük kimyasal reaktifleri kullanır, ancak son zamanlarda enstrümantal teknikler, enzimatik olmayan sindirim içinde geliştirilmiştir.
Kütle spektrometresi tabanlı proteomik analizlerde proteinlerin sindirim yaklaşımları şu başlıklar altında incelenebilir.
1- Enzimatik Sindirim;
Protein sindirimi için en yaygın kullanılan yöntem enzimatik sindirimdir. Bu amaca yönelik bir çok proteaz (bkz. Proteomik Analizlerde Kullanılan Tipik Proteazlar ) bulunmaktadır, bunların her biri özgüllük, verimlilik ve optimum sindirim koşulları bakımından kendi özelliklerine sahiptir. Bu proteazlar arasında tripsin en yaygın kullanılanıdır ve altın standart olarak görülür. Tripsinin bu kadar yaygın kullanılmasında ve altın standart olarak algılanmasında veri tabanlarının bir birleri ile tutarlılığını sağlamak ve böylece karşılaştırma kolaylığı elde etmek amaçlanmıştır. Tripsin kullanımının bir diğer nedeni de karboksi terminalinde bazik amino asitler bırakarak analizi daha kolay ‘y’ türü iyonlar oluşturmasıdır. Bir diğer avantajı tripsin iki farklı bölgeye özgüldür (Arg-C ve Lys-C) ve C terminusunda temel bir Arg veya Lys olan kısa peptit üretmesidir. Protein dizilerindeki bu amino asitlerin sıklığı ve yan grupları yüksek bazlıkları nedeniyle ortaya çıkan peptitler, tandem MS (MS / MS) ölçümlerinde Collision Induced Dissociation (CID) parçalanması için çok uygundur. Bu şu anki kromatografik ayırma, peptid parçalanması ve arama algoritmasına dayalı tanımlama yöntemleri için idealdir. Yani polipeptit zincirinde her arjinin ve lizin amino asidinin C-terminalindeki a.a. ile arasındaki bağı hidroliz eder. Lys ve Arg, insan proteomunda nispeten bol miktarda bulunan amino asitlerdir ve genellikle bir proteinde homojen olarak dağılmışlardır. Ayrıca tripsin enziminin fiziksel dayanımı olup kolay bir kullanım sağlar. diğer bir kullanım amacı ise tripsin enzimi düşük maliyetlidir ve kolay temin edilebilir.
Tipik bir triptik protein sindirimi için standart protokoller, proteinin üre veya guanidin gibi kaotropik ajanlar, ditiyotreitol (DTT) kullanarak disülfür köprülerinin indirgenmesi ve ardından sisteinlerin iyodoasetik asit veya iyodoasetamid ile alkilasyonu ile denatürasyonunu içerir. Reaktiflerin uzaklaştırılmasından sonra ve tampon değişiminden sonra, tripsin sindirimi tipik olarak 37 ° C’de bir amonyum bikarbonat tamponu içinde nötr pH’da gerçekleştirilir. Sindirimin çalışma şekline bağlı olarak, 18-24 saat sürebilir (gece boyunca sindirim). Sindirim, (formik) asit ilave edilerek durdurulur. Bu ve buna benzer sindirim protokolleri çok zahmetlidir ve bir çok numune işleme aşaması gerektirir.
Tripsin’in pek çok avantajına karşın, protein diziliminde veya pH uyumsuzluğunda Lys ve Arg eksikliği veya fazla miktarda olması gibi belirli durumlarda başka proteazların kullanılması gerekebilir.
Farklı bölünme spesifıkliklerine sahip çok çeşitli alternatif proteazlar mevcuttur( bknz. proeazlar.) Örneğin, pepsin gibi aspartik proteazlar, asidik koşullar altında aktiftir ve bu nedenle düşük pH’ı tercih eden hidrojen / döteryum değişiminde (HDX) deneylerde sıklıkla kullanılırlar.
2- Enzimatik Olmayan (Kimyasal) Sindirim;
Kimyasal parçalama, enzimatik sindirime alternatiftir. Kimyasal sindirim; Formik asit, hidroklorik asit veya asetik asitin seyreltik çözeltileri ile veya siyanojen bromür, 2-nitro-5-tiyosiyanobenzoat ve hidroksilamin gibi başka kimyasallarla işlemden geçirilerek elde edilebilir. Proteinlerin elektrokimyasal olarak bölünmesinin açık avantajları, reaksiyonun hızı (dakika) ve çevrimiçi MS ile bağlanma olasılığıdır. Elektrokimya, sonunda MS ile çevrimiçi olarak, disülfür köprülerinin indirgenmesinde de kullanılabilir ve bu nedenle daha yüksek protein kapsamına ulaşmada yardımcı olabilir.
Nonenzimatik sindirim, N-glikosilasyon sahalarının tahsisi için proteinlerde deamidasyon yapılan alanların tanımlanması sıklıkla kullanılır. Deamidasyonun in vivo rolünü değerlendirmek için de önemlidir.
Protein sindirimi için bölgeye özgü enzimatik olmayan yöntemlerin kullanılması, hız, basitlik, sağlamlık ve otomasyon kolaylığı açısından enzim temelli sindirim yöntemlerine kıyasla potansiyel avantajlara sahiptir.
3- Çoklu Sindirim Stratejileri;
Çoklu enzim sindirimi, proteazların bir kombinasyonunun kullanımı yoluyla protein ve proteom kapsama oranını arttırmak için uygulanan bir yöntemdir. Birden fazla enzimin kombine, paralel veya ardışık kullanımı,% 100 dizi kapsama gerçekleştirmenin tek yoludur. Özellikle bütün proteom dizilemesinde, paralel olarak çoklu enzimlerin kullanılması belirlenmiş peptid ve protein sayısını önemli ölçüde artış sağlamıştır. Çoğu kez tripsin, bir endoproteinaz, yani Lys-C, Lys-N ve Glu-C veya daha az spesifik enzimlerle kombinasyon halinde kullanılırken, birçok enzim kombinasyonu uygulamaya özgü kullanılabilir. Çoklu sindirim stratejileri büyük ölçekli protein dizileme yöntemleridir. Büyük ölçekli protein dizileme yöntemleri, kütle spektrometrik analizi için bir peptit topluluğu oluşturmak için kompleks protein karışımlarının enzimatik sindirimine dayanır.
Kaynaklar;
1-Preparation of Proteins and Peptides for Mass Spectrometry Analysis in a Bottom-Up Proteomics Workflow
2-Rebekah L. Gundry et al. Preparation of Proteins and Peptides for Mass Spectrometry Analysis in a Bottom-Up Proteomics Workflow (2009)
3-Franco Basile and Nicolas Hauser. Rapid Online Non-Enzymatic Protein Digestion Combining Microwave Heating Acid Hydrolysis and Electrochemical Oxidation (2011)