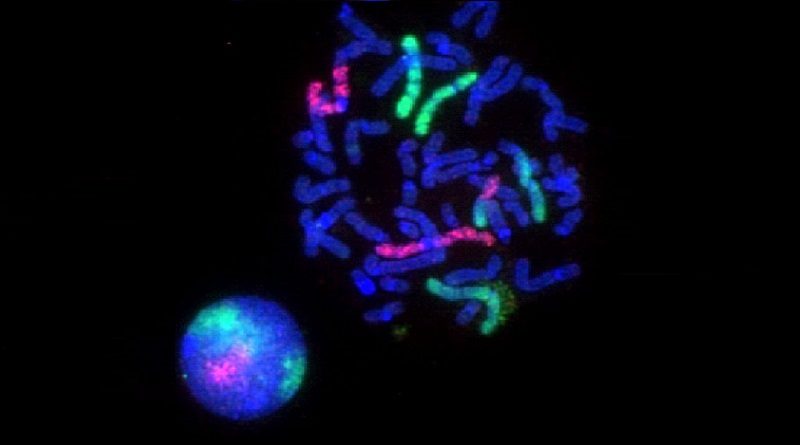
Floresan Insitu Hibridizasyon (FISH)
Nükleik asit dizilerinin (DNA ve RNA) morfolojik olarak korunmuş kromozomlar, hücreler veya doku kesitlerinde saptanarak gösterilmesini sağlayan ve temel olarak çift iplikli nükleik asit oluşumu esasını kullanan bir tekniktir. FISH’da nükleik asitler kendi hücresel ortamlarında gösterilmektedir.
Bir proteinin üretilebilmesi için ilgili genden mRNA üretilmelidir. Eğer bir dokuda ilgilendiğiniz mRNA üretiliyorsa bu, o dokuda ilgili genin aktif olduğunu yani genin okunduğunu gösterir. mRNA belirlenebilirse hangi genin okunduğu kolayca anlaşılabilmektedir.
FISH YÖNTEMİNİN UYGULANDIĞI ÖRNEKLER
- Fikse edilmiş kromozomlar,
- İnterfaz nukleusu üzerindeki çalışmalar,
- Uzatılmış tek zincirli DNA molekülleri,
- Nukleus ve alt ünitelerinin incelenmesi,
- Formalinle fikse edilmiş doku, kan ya da kemik iliği preparatları (parafin blok kesitleri)
FISH KULLANIM ALANLARI
Klinik Sitogenetik;
- İnterfaz nukleusunda kromozomal anomaliler
- Kromozomal anöploidi taramaları
- Preimplantasyon genetik tanısı / taraması
- Prenatal tanı
- Kanser sitogenetiği
- Mikrodelesyon sendromları
Gen Haritalanması;
- Hedef genin kromozomal lokasyonunun belirlenmesi
- Gen ekspresyon incelemeleri
Prenatal Tanı;
- Direkt amniyositlerin interfaz nukleuslarının incelenmesi
- Amniyosentez veya CVS materyallerinin doku kültürü sonrası incelenmesi
Preimplantasyon Tanı;
- Embriyo biyopsi materyalinin (blastomer) incelenmesi
Kanser Sitogenetiği;
- Örn. 9. Kromozomun abI geni ile 22.Kromozomun bcr geni bcr/abI dual color prob ile analiz (Ph kromozomu)
FISH’in Başlıca Aşamaları;
- Preperatların hazırlanması
- Materyalin preparat üzerine sabitlenmesi
- Prob ve hedef DNA’nın denatürasyonu
- Hibridizasyon
- Yıkama
- Görüntüleme
- Mikroskobi
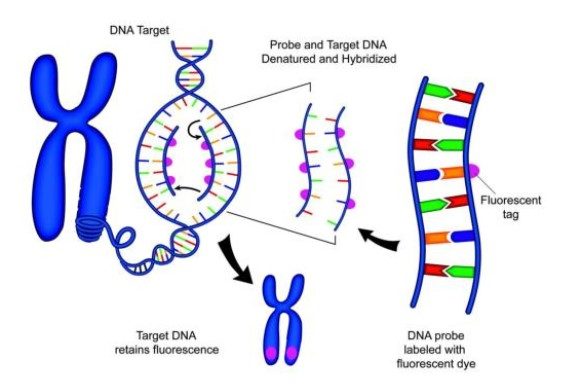
Kromozom Üzerinde Hibridizasyon
Materyale Uygulanan Ön İşlemler;
Hibridizasyondan önce,
Probun hedef olmayan nükleik asitlerle melezlenmesini engellemek
Proteinlerle veya diğer elemanlar ile spesifik olmayan etkileşimleri azaltmak için materyale aşağadaki işlemler uygulanmaktadır. Bu işlemler;
- RNaz Uygulaması;
DNA dizilerini saptamak amacı ile yapılan çalışmalarda sitoplazma ve nukleustaki RNA’ların probla melezlenmesini önler ve endojen RNA’nın temizlenerek istenmeyen zemin boyanmasını azaltmayı sağlamaktadır.
- Asetilleme;
Bu işlemde genellikle RNA/RNA FISH için uygundur. Trietanolamin+asetik anhidrid uygulaması ile (+) yüklü molekülleri nötralleştirir ve poli-L-Lizin kaplı lamlar kullanıldığına probun lama özgün olmayan bağlanmaları önlemektedir. Endojen biyotini yok eder.
- Dokuyu geçirgen hale getirme (Permeabilizasyon);
Proteaz uygulaması:
Proteazlar (pronaz E, proteinaz K, pepsin/HCI) prob ve saptama belirtecinin dokuya girebilmesine yardım etmektedir. Hedef nükleik asitleri maskeleyen proteinleri sindirerek etki ederler. Eğer konsantrasyon eksik olur ise normalin altında melezleme gerçekleşir.
HCI uygulanmas:
Bazı yöntemlerde kullanılmaktadır. Kesin etkisi bilinmemekle birlikte proteinlerin ekstraksiyonunu ve hedef dizilerin kısmen hidrolizini sağlayarak sinyalin artmasına katkıda bulunduğu düşünülmektedir.
Deterjan Uygulaması:
Diğer işlemlerin lipid ekstraksiyonunda yetersiz kaldığı düşünüldüğünde kullanılmaktadır.
Trition X-100, SDS (Sodyum Dodesil Sülfat)
- Endojen enzimlerin etkisiz hale getirilmesi;
Prob işaretleyici olarak herhangi bir enzim kullanılmış ise dokudaki endojen enzim etkisiz hale getirilmelidir. Örneğin, peroksidaz için, kesitlerde %1 H2O2, alkalin fosfataz için substrat solüsyonuna levamisol eklenir.
- Melezleme öncesi fiksasyon (Prehibridizasyon);
Proteaz uygulamasından sonra materyali paraformaldehit ile tekrar fikse etmek yararlı olur. Melezleme öncesi fiksasyon hücredeki DNA ve RNA’nın daha sonraki işlemler sırasında kaybını önlemek için yapılır.
Floresan İn Situ Melezlemede Prob Seçimi
FISH’de kullanılacak probların seçilmesinde iki temel önemli nokta mevcuttur.
- Prob olarak kullanılacak nükleik asidin tipi
- Uygun işaretleme cinsi
Prob Tipleri;
Prob olarak hazırlanan nükleik asitler; çift iplikli DNA (dsDNA), tek iplikli DNA (ssDNA), tek iplikli RNA ve oligonükleotidler olarak sınıflandırılmaktadır.
Kromozomlar üzerinde gerçekleştirilen FISH’de ve viral DNA tayinlerinde genellikle DNA probları,
mRNA tayinlerinde ise tek iplikli RNA probları veya oligonükleotidler tercih edilmektedir.
Problar izolasyon / klonlama, in vitro transkripsiyon veya kimyasal sentez yolu ile elde edilebilmektedirler.
DNA Probları:
- Yüksek spesifik aktivite göstermektedirler.
- Prob olarak kullanılmadan önce denatüre edilmelidir.
RNA Probları:
- RNA-RNA hibridleri en stabil hibridlerdir.
- RNA probları düşük stabilite gösterir ve RNaz’larla kolaylıkla yok edilebilmektedirler.
Oligonükleotid Probları:
- Dizi hedef diziye tamamlayıcı olarak dizayn edilir.
- Problar çok stabildir.
- Küçük boyutundan dolayı hedefe kolayca girebilirler.
Probun Uzunluğu;
Maksimum melezleme oranı uzun problar ile elde edilmektedir. Ancak fish^de kısa probların kullanılması gerekmektedir. Bunun nedeni ise, probun hücre veya kromozomlar çevresindeki yoğun matriksten geçerek hedefe ulaşması gerekmektedir. Probların 500 ve üzerinde baz yoğunluğuna sahip olanları birçok doku için en iyi sinyali verir. Çok kısa problar ise çok zayıfsinyal verirler, bazen ise istenmeyen işaretlere neden olabilmektedirler. Dokunun özelliği, fiksasyon tipi, melezleme öncesi işlemlerin uygulanıp uygulanmamasına göre prob uzunluğunun seçimi değişmektedir. Oligonükleotidler tek iplikli oluşları ve çok iyi penetrasyon özelliklerine sahip olmalarından dolayı FISH için oldukça avantajlı problardır.
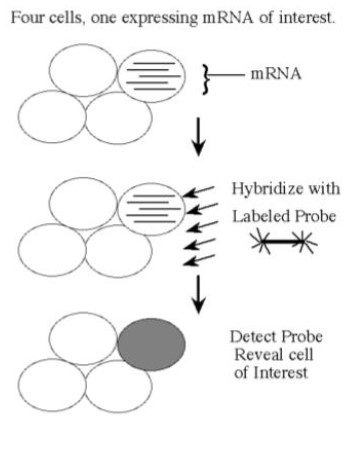
Probun İşaretlenmesi;
İzotopik İşaretleme:
İşaretleme radyoaktif madde ile yapılır ve işaretin belirlenmesi için ‘’otoradyografi’’ kullanılmaktadır. Reaksiyon sonucunun hızına, prob stabilitesine ve çalışılan konuya göre farklı tipte izotoplar kullanılmaktadır.
H3 işaretli problar, subsellüler uygulamalar için kullanılır. Yüksek çözünürlüğe sahiptir. İşaretli problar birkaç yıl saklanabilir.
S35 probları, en yaygın olarak kullanılan radyoaktif işaretlemedir. S35 işaretli problar, özellikle hücresel uygulamar için uygundur. İşaretli problar birkaç ay içinde tüketilmelidir.
P32 probları, geniş çaplı alanlar için uygundur. İşaretli problar 1 hafta içinde kullanılmalıdır.
İzotopik Olmayan İşaretleme:
İşaretleme radyoaktif olmayan maddelerle yapılır ve işaretin tayini için immünohistokimyasal yöntemler kullanılmaktadır.
Denatürasyon, Melezleme ve Yıkamalar
Melezleme Öncesi İşlemler (Prehibridizasyon)
Zemin boyanmasını önlemek için genellikle prehibridizasyon gereklidir. Prehibridizasyon solüsyonu, prob ve dekstran sülfat dışında melezleme karışımındaki tüm elemanları içerir.
Denatürasyon
DNA/DNA FISH için prob ve hedef dizilerin denatürasyonu gereklidir. Denatürasyon asit, ısı, alkali uygulamasıyla yapılır. Alkali maddeler biotinli problarla kullanılamaz. Isı ile denatürasyon uygulamanın basitliği ve daha etkili oluşu nedeniyle en çok kullanılan yöntemdir. Denatürasyon işlemleri genellikle morfoloji kaybına neden olmaktadır. Bu nedenle, hedef DNA’nın denatürasyonu prob denatürasyonuna göre daha kritik bir işlemdir.
Melezleme
Prob ve hedef nükleik asitler tek iplikli hale getirildikten sonra, DNA/DNA melezleri için 37°C ‘de ve RNA/RNA melezleri için 50-55° C’da bir gece inkübasyona bırakılırlar. Bu sıcaklıklar genellikle Tm değerinin 20-25° C altındadır.
Melezleme Sonrası Yıkamalar (Posthibridizasyon)
Melezleme sonrası yıkamalar zayıf bağlanan probu temizleme ve sadece doğru eşleşmiş olanları bırakmak amacıyla uygulanır. Genellikle önce düşük sonra yüksek ‘’strigency’’ yıkamaları yapılmaktadır. Böylece zayıf melezlenmiş veya melezlenmemiş prob ve melezleme solüsyonunun diğer elemanları temizlenir, daha sonra tuz konsantrasyonu düşük ve sıcaklığı yüksek yıkamalar ile probun melezleme özgünlüğü son kez düzenlenmiş olur. RNA/RNA melezlenmesi için ek bir işlem daha uygulanmaktadır. RNA probları yapışmaya eğilimlidir ve bu nedenle yoğun zemin sinyali oluştururlar. Bu nedenle melezleme sonrasında RNaz uygulaması yapılmaktadır.
Fısh Tekniğinin Sitogenetikteki Avantajları
- Kromozom eldesi olmasa bile nukleus incelenerek kromozomlar hakkında bilgi edinilebilmektedir.
- Analiz için eski preparatlar, aylar hatta yıllar sonra kullanılabilmektedir.
- Kısa sürede sonuç verilir, uzun dönem kültür gerektirmez.
- Mozaikliğin belirlenmesi açısından kolaylık sağlar.
- Marker kromozomların kaynağı belirlenebilir.
- Kromozomal mikrodelesyon sendromları belirlenebilmektedir.
Dezavantajları
- Sadece incelenen kromozom hakkında bilgi sağlamaktadır.
- Hibridizasyon başarısı düşükse değerlendirmek zordur.
- Yanlış pozitiflik oranı %10-15 arasındadır.
- Prob sayısı kısıtlı olmakla birlikte aynı anda 5-6 kromozom sayısal olarak incelenebilmektedir.
Şevval ÇAKIR
Kaynakça;
- https://tr.scribd.com/presentation/53364559/Kromozom-Bantlama-Ve-Fish
- https://studylibtr.com/doc/682247/boyama-analiz-kromozom-boyama–bantlama-
- https://www.slideserve.com/gittel/in-situ-melezleme-h-br-d-zasyon