Kızıl Ötesi Spektroskopisinde Işık Göründü
Kızılötesi spektroskopinin ışık iletimine güvenmesi birçok analitik uygulamanın hassasiyetini sınırlar. Moleküllerden kızılötesi radyasyonun emisyonuna bağlı olan bir yaklaşım bu sorunu çözmeyi vaat ediyor.
Atomlardaki moleküller kızılötesi ışıkla ışınlandığında salınıma uğrar. Bu titreşimleri yönlendiren belirli ışık frekansları moleküller tarafından emilir ve moleküllerin kimyasal yapısına ve ortamına bağlıdır. Dolayısıyla bir numunenin absorpsiyon spektrumu, kimyasal bileşimini karaterize etmek için moleküler parmak izi olarak kullanılabilir. Bu, kızılötesi spektroskopiyi yaygın bir analitik teknik haline getirmiştir. Bununla birlikte, düşük konsantrasyonlarda analit ve sudaki numuneler için kızılötesi spektrumların ölçülmesi zordur. Pupeza et al.[1], bu sınırlamaları hafifletmeyi vaat eden kızılötesi spektroskopi için bir konsept sunmaktadır. Kızılötesi ışık, Güneş’in astronomik gözlemlerini yaparken William Herschel’e neden olduğu sorunun bir sonucu olarak keşfedildi[2]- Gözünde, filtrelemek istediği rahatsız edici bir ısınma hissi yarattı. Ancak bugün, çok sayıda analitik amaç için kızılötesi radyasyonun faydaları büyük ölçüde takdir edilmektedir. Uygulamaları uzaydaki moleküllerin saptanmasına[3,4], marstaki su dahil[5], canlı organizmalarda proteinlerin moleküler mekanizmalarının deşifre edilmesine[6,7] bağlı olarak değişiyor. Günümüz dünyasında, yiyecek analizlerinde[6,8] ve adli polis soruşturmalarında[6,9] kullanılıyor. Kızılötesi spektroskopiyi kliniğe getirmek için çok fazla araştırma yapılmaktadır, çünkü biyolojik doku ve vücut akışkanlarının analizi hastalıkların teşhis ve tedavisinde kullanılabilir[6,7,10]. Biyolojik örneklerin kızılötesi analizinin önündeki ana engellerden biri, kızılötesi radyasyonun su tarafından güçlü bir şekilde soğurulmasıdır- çoğu amaç için örnek kalınlığını 10 mikrometrenin altında sınırlayan problem. Bu sorun ayrıca numunedeki moleküllerin durumunu manipüle etmek için numunelere sulu reaktif çözeltileri (asitler ve tuzlar gibi) eklemeyi zorlaştırır. Bu tür manipülasyonlar, örneğin, küçük moleküllerin proteinlere bağlanmasını incelemek için arzu edilir ve ultraviyole veya görünür spektroskopi kullanıldığında standart uygulamadır. Ayrıca, kızılötesi radyasyon su tarafından soğurulduğu için numuneler genellikle konsantre edilmeli veya kurutulmalıdır.
Pupeza ve arkadaşları bu sorun için bir çözüm bildirmektedir. Örnekleri, orta kızılötesi ışığın ultra kısa darbesi (femtosaniye ölçeğinde; 1 fs 10–15 saniyedir) ile ışınlarlar. Işığın bazı belirli frekansları numune tarafından soğurulur, titreşimler üretir. Bu titreşimler, Bu titreşimler darbe sona erdikten sonra devam eder ve titreşim enerjisi çevreye yayılana kadar devam eder (birkaç pikosaniye sürer; 1ps 10–12 s). Titreşen atomlar kısmi elektrik yükleri taşıdığından, salınımları, salınan elektronların bir antende elektromanyetik radyasyon üretme şekline benzer şekilde elektromanyetik radyasyon üretir. Üretilen radyasyon, moleküler titreşimlerle aynı frekansa sahiptir ve bu nedenle tüm örnek moleküller hakkında bilgi taşır- bu nedenle yazarlar buna küresel moleküler parmak izi diyorlar. Elektro-optik örnekleme adı verilen bir yöntemle ikinci bir ultrashort ışık darbesi kullanılarak, bu sefer kızılötesine yakın spektral aralıkta ölçülür [11]. Yazarların yaklaşımı kavramsal olarak geleneksel soğurma ölçümlerinden farklıdır. Absorbsiyon spektroskopisinde sinyal, örnekle etkileşmeyen ışıktan yalnızca dolaylı olarak algılanır(Fig. 1a). Bu nedenle, zayıf emilimin saptanması çok zordur, çünkü iletilen ışığın yoğunluğunu sadece marjinal olarak değiştirir. Teorik olarak, zayıf absorplayıcıların algılanması, gelen ışığın yoğunluğunu arttırarak geliştirilebilir ancak yaygın olarak kullanılan kızılötesi dedektörler daha yüksek ışık yoğunluğunda daha az hassas hale gelir [12]. Aksine Pupeza ve ark. doğrudan istenilen sinyali –titreşen moleküllerden yayılan radyasyon- ölçebiliyor(Fig 1b). Bu, görünür spektral aralıktaki absorbans ve floresan ölçümleri arasındaki farka benzerdir: floresan ölçümleri daha hassastır, çünkü doğrudan örnekten bir sinyal algılarlar ve hatta tek bir molekülden bile algılayabilirler.
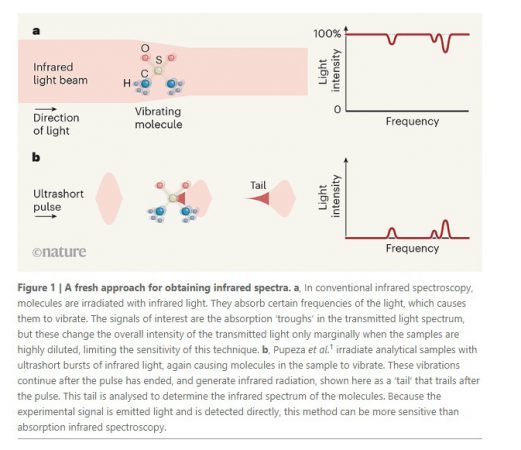
Pupeza ve meslektaşları yaklaşımlarının yüksek hassasiyetini çeşitli şekillerde göstermektedirler. Örneğin, çözeltide bir bileşiğin 40 kat daha düşük konsantrasyonlarını tespit edebildiler ve absorpsiyon spektroskopisini kullanmaktan daha iyi iki benzer bileşik arasında ayrım yapabildiler. Ayrıca, gelen ışığın neredeyse tamamını bloke eden biyolojik örnek spektrumları elde ettiler(bir durumda, en az % 99,999). Böylece, yeni yaklaşım ışığı şu anda kullanılan yöntemlerin sadece karanlığı gördüğü yerde algılar. Bu etkileyici bir başarıdır ve konvansiyonel kızılötesi spektroskopinin her iki ana sorununu da hafifletebilir: hassasiyet ve su ile güçlü kızılötesi absorpsiyon. Birçok durumda numune konsantrasyonu veya kurutma ihtiyacını ortadan kaldırarak numune hazırlamayı basitleştirecek ve yeni uygulamalar açacaktır- özellikle sulu biyolojik numuneleri içerenler.
Yazarlar, metodu daha ileri götürmek için, örneğin ışınlamak için kullanılan lazerin gücünü arttırmak gibi çeşitli fikirler önermektedir. Bu tür önlemlerin şu anda yöntemin yığın sudaki tek molekül duyarlılığının nihai hedefine ulaşmasını engelleyen teknolojik boşluğu daha da daraltması umulmaktadır. Diğer zorluklar, proteinler, lipitler ve nükleotitler için belirgin ve diagnostik olarak faydalı sinyallerin bulunduğu daha kısa dalga boylarını içerecek şekilde ölçümlerin spektral aralığını arttırmak ve rekabetçi bir fiyata ticarileştirmeye uygun bir spektrometre geliştirmek olacaktır.
Çeviren ve Yazan: Aybüke Elif US
Kaynak makale: https://www.nature.com/articles/d41586-019-03866-w
Makalede bulunan referanslar:
[1] Pupeza, I. et al. Nature 577, 52–59 (2020)
[2] Herschel, W. Phil. Trans. R. Soc. Lond. 90, 284–292 (1800)
[3] Van Dishoeck, E. F. Annu. Rev. Astron. Astrophys. 42, 119–167 (2004)
[4] Ehrenfreund, P. & Charnley, S. B. Annu. Rev. Astron. Astrophys. 38, 427–483 (2000)
[5] Bibring, J.-P. et al. Nature 428, 627–630 (2004)
[6] Chalmers, J. M. & Griffiths, P. R. (eds) Handbook of Vibrational Spectroscopy Vols 4 & 5 (Wiley, 2001)
[7] Barth, A. & Haris, P. I. (eds) Biological and Biomedical Infrared Spectroscopy (IOS, 2009)
[8] Sun, D.-W. (ed.) Infrared Spectroscopy for Food Quality Analysis and Control (Academic, 2008)
[9] Chalmers, J. M., Edwards, H. G. M. & Hargreaves, M. D. (eds) Infrared and Raman Spectroscopy in Forensic Science (Wiley, 2012)
[10] Bunaciu, A. A., Fleschin, Ş., Hoang, V. D. & Aboul-Enein, H. Y. Crit. Rev. Anal. Chem. 47, 67–75 (2017)
[11] Wu, Q. & Zhang, X.-C. Appl. Phys. Lett. 67, 3523–3525 (1995)
[12] Theocharous, E., Ishii, J. & Fox, P. N. Appl. Opt. 43, 4182–4188 (2004)