PCR Sorunları ve Çözüm Önerileri
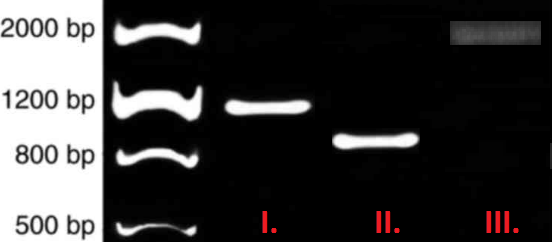
PCR yapıldıktan ve Jel Elektroforez ile yürütüldükten sonra ilgili bölgenin çoğalıp çoğalmadığı UV ışın ile ortaya çıkan bant boyları ile anlaşılır. Bu bant boyları çoğaltılan bölgenin boyu (bp) ile belirlenir.
Her Jel yüklemesinde örneklerle beraber uzunluğu bilinen DNA Ladder da yürütülür. Ve elektrik akımı ile açılan DNA Ladder bantlarına göre örneklerin çoğaldığı bölge boyu tespit edilir ve buna göre PCR’ın olup olmadığı anlaşılır.

Örnek verecek olursak ilk sırada yürüyen 1200bp DNA Ladder.
Bu Ladder’a göre A örneğinin boyu 1000bp , B örneğinin boyu 800bp ve C örneğinin boyu 300 bp diye yorumlayabiliriz. Fakat Jel Elektroforez sonucu her zaman bu kadar net ve doğru bölgede olmayabilir.
1.Sorun: Teknik Sorunlar:
Teknik sorunlar ile karşılaşıldığında ilk akla gelecek olan o jelde yürütülen tüm örneklerde bant görüntüsünün olup olmamasına bakılır.
Eğer hiçbir kuyuda yani örnekte bağlanma olmadıysa 3 durum akla gelir.
1- Jel tamponu hazırlanırken floresan boya konulmamış yada uzun süre gün ışığına maruz kalmış etkisini yitirmiştir.
2- Aynı PCR cihazında çalışılmış ise örnekler; PCR cihazında çalışma esnasında cihaz yada PCR programı kaynaklı sorunlar yaşanmış olabilir.
3- Pcr mixi hazırlanırken DNA, primerler vb. gibi PCR ürünlerinden bir veya bir kaçı reaksiyona konulmayı unutulmuş ya da bozulmuş, degrede olmuş vb. olabilir.
2.Sorun: Exon Delesyonları:
Jel elektroforez ile yürütülme sonrasında gene ait exonlarda bant olmaması ya da bazı exon veya exonlarda bant olmaması durumunda;
İlk akla gelmesi gereken exonlara ait primerlerin bozulmuş olması ya da tüp içerisine konulmayı unutulmuş olmasıdır. Bu durumun en basit teyidi için o çalışmalardan sonraki çalışılmış aynı genin aynı exonlarına ait bant olup olmamasına bakılır. Eğer ki sonraki çalışmalarda da o exonlarda bant yok ise muhtemelen primer kaynaklı bir bozulma söz konusu olabilir. Fakat sonraki çalışmalarda aynı genin aynı exonlarında bant var ise o zaman ilk çalışmadaki exon yada exonlarda delesyon şüphesi akla gelmelidir. Bunun teyidi için ise o exonlarda çalıştığı bilinen bir pozitif kontrol ile pcr + jel elektroforez yüklemesi yapılır.
 Yandaki jel elektroforez görüntüsünde 6 exonluk bir gene ait görüntü verilmektedir. II. Exonda bant olmaması durumuna bir örnektir. Bu durumda aynı gene ait II. Exon çalıştığı bilinen bir dna (optimizasyon dnası) ile pcr + jel elektroforez yapılır.
Yandaki jel elektroforez görüntüsünde 6 exonluk bir gene ait görüntü verilmektedir. II. Exonda bant olmaması durumuna bir örnektir. Bu durumda aynı gene ait II. Exon çalıştığı bilinen bir dna (optimizasyon dnası) ile pcr + jel elektroforez yapılır.
 Çalıştığı bilinen DNA ile yapılan PCR da bant var fakat tekrar edilen çalışmanın genine ait aynı exonda bant yok ise o exon yada exonlar için delesyon var denilebilinir. (Ayrıca bu delesyonlar MLPA yöntemi ile de teyit edilebilinir. Bunun için MLPA Analizi ve Örnek bir protokol yazımı okuyabilirsiniz.)
Çalıştığı bilinen DNA ile yapılan PCR da bant var fakat tekrar edilen çalışmanın genine ait aynı exonda bant yok ise o exon yada exonlar için delesyon var denilebilinir. (Ayrıca bu delesyonlar MLPA yöntemi ile de teyit edilebilinir. Bunun için MLPA Analizi ve Örnek bir protokol yazımı okuyabilirsiniz.)
PCR küçük bir kontaminasyondan bile etkilenip yanlış sonuçlar doğurabileceği için delesyon şüphesi pcr ve analiz yapanların aklından çıkmaması gereken bir durumdur. Delesyon olan bir bölge ile farklı pcr yöntemleri denenerek çoğaltıp delesyon yokmuş gibi sonuç vermek sık rastlanabilecek bir hatadır.
3.sorun: Zayıf Bantlar:
Zayıf bant genelde pcr protokolündeki bir yanlışlığın göstergesidir. Böyle durumlarda şunlar uygulanabilir;
1- Genelde bu gibi durumlarda ilk önce yapılması gereken PCR anaeling (bağlanma) ısısı ve süresini değiştirmektir. Genelde 60°C olan anaeling sıcaklığı 50°C ya da 70°C kadar kademeli olarak düşürülüp arttırılabilir. Süresi ise yaklaşık 2.5 dk kadar yükseltilebilir.
Kademeli olarak düşürülüp veya artırılan sıcaklıktaki yapılan PCR işlemine gradient PCR denir. Örnek verecek olursak sıcaklığı 50 °C ile 60 °C arasında ayarlanan PCR cihazının sıcaklığı bilinen kuyularına, 4 tane aynı örnek (aynı exon, aynı enzim, aynı mix) yerleştirilir ve her sıcaklıktaki çalışma kalitesi jel elektroforez ile gözlenir.
2- PCR cycle (döngü) miktarını da artırmak çözüm olabilir. Fazla miktarda cycle fazla ürün bağlanmasını sağlar. Fakat yanlış bölgeleri de çoğaltabilir.
3- PCR mixi içerisindeki DNA, enzim ya da primer miktarları artırılarak daha sağlıklı bir PCR ürünü beklenir.
4- Kullanılan mix içerisine MgCl2 ilave edilerek daha sağlıklı bir PCR ürünü elde edilebilir. Düşük MgCl2 ürün oluşumunu azaltırken, yüksek MgCl2 spesifik olmayan ürün oluşumuna sebep olur. (Tavsiye edilen konsantrasyon aralığı 0.5-2.5 mM/reaksiyon MgCl2) Yine fazla dNTP MgCl2 konsantrasyonunu düşüreceğini de unutmamalıyız.
4.sorun: Artefaktüel ürünler/Primer dimer/Smear
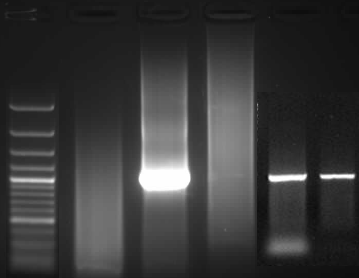
Jel elektroforezindeki bu görüntü bize bağlanması gereken bölge ile birlikte başka bölgelerinde bağlandığını gösterir.
Her ne kadar istediğimiz boyda bant elde etmiş olsak bile bir smear’li PCR sanger sekanslamada asla çalışamazken yeni nesil sekanslamada da çalışması çok zor bir ihtimaldir.
Bu durumlarda yapılması gerekenler şunlardır;
1- PCR cihazındaki anaeling sıcaklığı ve süresini değiştirmek.
2- Cycle (döngü) miktarını azaltmak gerekir. Fazla miktarda döngü istenmeyen ürün elde ettirir.
Birden fazla farklı enzimler ile de PCR yapmak istenmeyen bantların oluşumunu engelleyecektir. Ayrıca primer tasarımları, dna kaliteleri, primer saklama koşulları da pcr daki sorunların kaynağını oluşturabilmektedir.
Yazar: Ömer Cihangir TAŞKAN
Tarih: 3 Ekim 2018
Linkedin Profili : https://www.linkedin.com/in/cihangirtaskan/




