Mycobacterium Tuberculosis ve Virülans Faktörleri
Mikobakterilerin insanlık tarihinin ilk dönemlerinden beri var olduğu ve hastalık oluşturduğu düşünülmektedir. Bu büyük bakteri ailesinin, günümüzün ilerleyen laboratuvar teknolojileriyle tanımlanmış 130’dan fazla üyesi bulunmaktadır (Gutierrez et al. 2005).
Bu türler patojen, patojen olmayan (saprofit) ve fırsatçı mikobakteriler olmak üzere üç gruba ayrılırlar. Sayı olarak en az üyeye sahip olan patojen mikobakteri grubu, en önemli mikobakteri türü olan M. tuberculosis’i de içinde barındırır. Mycobacterium cinsi, Prokaryot aleminin, Firmicutes bölümünün, Actinobacteria sınıfının, Actinomycetales takımının, Mycobacteriaceae ailesine dahil olup bu ailedeki tek cinstir (Köksal et al. 2003).
İnsanda en sık hastalık oluşturan mikobakteri türü, tüberküloz hastalığının etkeni olan M. tuberculosis’tir. M. tuberculosis, M. tuberculosis kompleksinin bir üyesidir. Bu kompleks içinde M. tuberculosis, M. bovis, M. africanum, M. microti, M. pinnipedii ve M. caprae bulunurlar. DNA hibridizasyon çalışmaları sonucunda bu kompleksteki suşlar arasında yakın homoloji olduğu gösterilmiştir (Gutierrez et al. 2005).
- tuberculosis, Gram pozitif 1-4 µm uzunluğunda 0.3-0.6 µm eninde, ince ve bazen hafifçe kıvrık, hareketsiz, sporsuz, kapsülsüz çomak şeklinde ve zorunlu aerobik bir bakteridir. Tüberkül basilinin bazı karakteristik özellikleri vardır. Bunlar yavaş büyüme, dormansi, karmaşık hücre membranı hücre içi patogenezi ve genetik homojenliktir. M. tuberculosis büyüme süresi sentetik ortam veya enfekte olmuş canlıda ortalama 24 saattir (Cole et al. 1998).
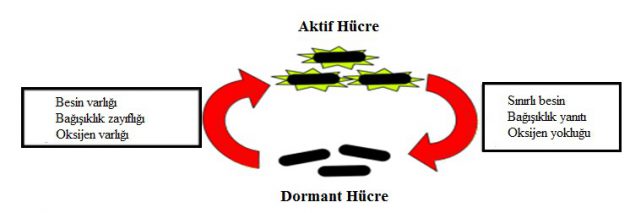
Basil enfekte doku içerisinde suskun bir hale geçer ve bu durum dormansi olarak adlandırılmaktadır. Dormansi durumu basilin metabolik faaliyetlerinin durdurulmasıdır. Fakat bu durumda enfeksiyon etkisi ortadan kalkmamaktadır. Bağışıklık yaşlanma veya bağışıklık baskılanması yolu ile azalır ve ilk enfeksiyondan sonra dormansi durumuna geçen bakteriler herhangi bir salgın durumunda yeniden aktif hale geçebilir (Cole et al. 1998).
M.tuberculosis’te mumsu bir kılıf bulunur ve bu yapı bakteriyi konak hücrelerden temizlenmeye karşı dirençli hale getirir. M. tuberculosis hücre içi bir patojen olup konağın makrofajlarına yerleşir. Burada hücre içi ve lokal doku ortamını değiştirerek kazeöz, nekroz ve granuloma oluşturur. Çeşitli mikobakteri türü enfeksiyonları makrofajlar içerisinde siklik AMP (cAMP) patlamasına neden olarak hücre içi sinyal iletimini etkiler (Agarwal et al. 2009).
Bakteri ayrıca hücre içerisinde hayatta kalabilmek için konakta fagozom oluşumunu engeller (Bell et al. 2011).
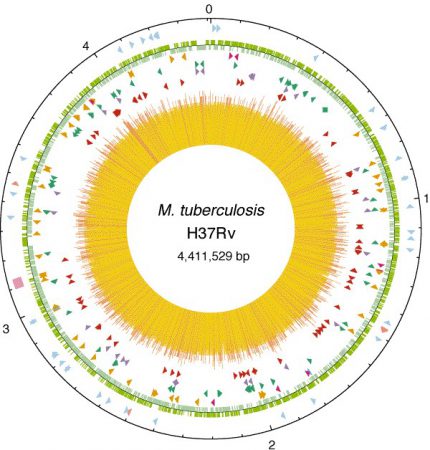
M.tuberculosis genomu, 4,411,529 baz çifti, 4 bin gen ve yaklaşık %65,6 G-C içeriğine sahiptir. Kromozom halkasal yapıda ve Escherichia coli genomuyla yaklaşık aynı büyüklüktedir. M. tuberculosis’in genomu yaklaşık 7 milyon bp’lik kromozomu olan M. smegmatis gibi hızlı üreyen çevresel mikobakteri türlerinden daha kısadır. Bu durum hücre içi ortamdaki genetik izolasyona ve hücre içi ortamda gereksiz olan genlerin kaybına bağlanmaktadır. Genomundaki yüksek G-C içeriğini yansıtacak şekilde M. tuberculosis glisin, alanin, prolin ve arjininden zengin proteinler içerirken, A-T’den zengin kodonların kodladığı lizin ve asparajin amino asitleri düşük oranlarda bulunmaktadır. Yüksek G-C içeriği bakterinin aerobik yaşam şekliyle ilişkilidir. Buna karşın, M. tuberculosis anaerobik ortamlara da uyum sağlayabilecek metabolik potansiyele sahiptir (Brosch et al. 2000).
M.tuberculosis birçok antibiyotiğe doğal olarak dirençlidir ve bu da tedaviyi zor hale getirmektedir. Bu direnç esas olarak geçirgenlik bariyeri görevi olan son derece hidrofobik hücre zarından kaynaklanmaktadır. Ancak birçok potansiyel direnç belirleyiciler genomda kodlanmıştır. Bunlar; Hidrolitik veya ilaç değiştirici enzimler örneğin; β-laktamazlar, birçok potansiyel dışa atım sistemleri ve ATP bağlanma kaseti (ABC) taşıyıcılarıdır. Bu direnç mekanizmaları hakkında mevcut olan bilgiler sayesinde ilaçların daha iyi kullanımı ve yeni tedavilerin geliştirilmesi sağlanmaktadır (Cole et al. 1998).
Tüberküloz basilinin hücre duvarı diğer bakterilere göre çok daha kalındır ve yüksek oranda lipid içerir. Hücre duvarının dış kısmı mikolik asit denen, 60- 90 karbonlu, uzun ve dallı yağ asitlerinden oluşur. Mikolik asitler arabinogalaktan molekülleri aracılığıyla daha iç kısımdaki peptidoglikan tabakasına bağlanırlar. Hücre duvarının iç kısmını oluşturan peptidoglikan tabakası, tüberküloz basilinin şeklini veren ana yapı olmanın yanısıra, yapısal bütünlüğün korunmasında da önemlidir. Dıştan içe doğru mikolik asit, arabinogalaktan ve peptidoglikandan oluşan bu sağlam yapı, bir zırh gibi mikobakteri hücresini çevreler. Bu yapının sağlamlığı, lipoarabinomannan, mannofosfoinositid, serbest lipid ve polipeptidlerin de katılımıyla, daha da artar. Arabinogalaktan tabakası, mikolik asitlerle peptidoglikan arasında köprü görevi gören dallanmış bir polisakkarittir (Brennan 2003)
M.tuberculosis hücre duvarı, diğer bakterilerin hücre duvarı ile karşılaştırıldığında oldukça kalın ve olağanüstü bir lipofilik özellik taşır. M. tuberculosis hücre duvarı üç tabakadan oluşmaktadır (Soulen et al. 1998).
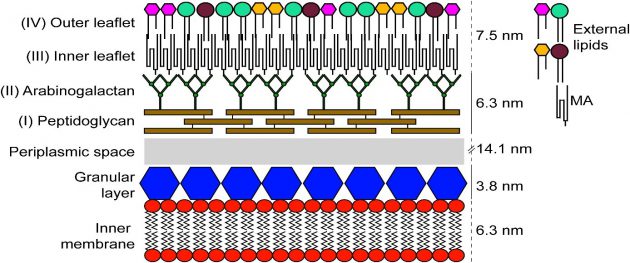
Peptidoglikan (mürein), plazma zarının üzerinde bulunan en iç tabakadır. Kısa peptit zincirleri ve çapraz bağlarla sıkıca bağlanan uzun polisakkarit zincirlerinden oluşmuştur. Hücrenin sert yapısını sağlar. Arabinogalaktan, peptidoglikan tabakasının üzerinde bulunan ikinci tabakadır. Hücre duvarı kitlesinin %35’ini oluşturur ve peptidoglikan tabakasına fosfodiester köprüleriyle bağlıdır. Arabinogalaktanların yan zincirindeki uç arabinaz birimlerine mikolik asit diye adlandırılan uzun zincirli bir grup yağ asidi kovalent olarak bağlanır. Mikozidler, en dış tabakayı oluşturur. Peptidoglikolipitlerden oluşmuştur. Hücre duvarında bulunan ve duvar ağırlığının %60’ını oluşturan lipitler bu tabakada bulunur. Bu lipitler mikolik asitleri içerir (Ullrich 2009).
Mum kıvamındaki bu kalın hücre duvarı birçok ilaç molekülünün hücre içine girişini engelleyerek doğal bir direnç oluşturur. M. tuberculosis’e etkili olacak ilaçlar öncelikle bu tabakadan kolayca geçebiliyor olmalıdır. Bunun yanısıra lipidden zengin bu kalın hücre duvarı, mikroskobik inceleme amacıyla uygulanan birçok boyanın hücre içine geçişine de engel olur. Bu nedenle mikobakterilerin boyanabilmesi amacıyla diğer bakteriler için kullanılan boyama yöntemlerinden daha farklı boyama yöntemleri kullanılır (Ryll et al. 2001, Ullrich 2009).
M.tuberculosis, hücre duvarı yapısında oldukça fazla lipit içermesi nedeni ile asit ve alkole dayanıklıdır. Konak hücreleri tarafından salınan eritici enzimlere ve bakterisidal ilaçlara karşı dirençlidir (Ullrich et al. 2009).
Mycobacterium tuberculosis Virülans Faktörleri
M.tuberculosis en başarılı insan patojenleri arasında yer almasına rağmen patojenitesi hakkında pek fazla bilgi bulunmamaktadır. Robert Koch tüberküloz basilinin keşfi sırasında basilin toksin üretmediğini göstermiştir. M. tuberculosis virülans faktörleri, proteinlerin bilinen veya tahmin edilen işlevlerine göre gruplandırılmıştır(Smith 2003).
Aynı zamanda M. tuberculosis’te tanımlanan birçok virülans faktörü M. smegmatis gibi patojen olmayan mikobakteri türlerinde de görülebilmektedir. Bakterinin virülansıyla ilgili olarak, bir genin varlığı ya da yokluğundan daha çok ne kadar eksprese edildiği önemli olabilmektedir (Pym and Small 2006).
M.tuberculosis’in ölümcül olmasının sebebinin basit bir cevabı ne yazık ki son yüzyıldır elde edilen bilgilere rağmen bulunamamıştır. M. tuberculosis’in diğer patojen bakteriler gibi hastalık nedeni olan klasik bir virülans faktörleri yoktur. Mortalite (ölüm) ve morbiditi (hastalık) terimleri virülans için kullanılmaktadır. Virülans ile ilişkili diğer bir parametre ise, bakteriyel yüktür yani ilk enfeksiyondan sonra konak canlı içinde bulunan bakteri sayısıdır. M. tuberculosis bir hücre içi patojeni olduğu için genelde makrofaj hücrelerini enfekte etmektedir. Bu nedenle fagositik hücreler M. tuberculosis ve mutantlarının ölümcüllüğünü analiz etmek için kullanılabilir (Smith 2003).
| Hücre salgısı ve zarf işlevi | Kültür filtre proteinleri, hücre yüzey bileşenleri |
| Hücre metabolizması ile ilgili enzimler | Lipit ve yağasidi metabolizması, aminoasit ve pürin biyosentetik genleri, metal alımı, anaerobik solunum ve oksidatif stres proteinleri |
| Transkripsiyon düzenleyiciler | Sigma faktörleri, cevap düzenleyiciler, diğer transkripsiyon düzenleyiciler
|
M.tuberculosis virülans faktörleri (Smith 2003)
Fatih KARABULUT
Kaynaklar;
- Gutierrez, M., Brisse, S. and Brosch, R. 2005. Ancient origin and gene mosaicism of the progenitor of Mycobacterium tuberculosis. PloS Pathogens; 1: 55-61.
- Köksal, F. ve Yaman, A. 2003. Farklı bir bakteri topluluğu mikobakterilerde hücre duvar yapısı. 21. Yüzyılda Tüberküloz Sempozyumu, , Samsun, Sempozyum Kitabı: 34-47.
- Cole, S. T., Brosch, R., Parkhill, J., Garnier, T., Churcher, C., Harris, D., and Gordon, S. V. 1998. Deciphering the biology of Mycobacterium tuberculosis from the complete genome sequence, Nature, 393 (6685), 537-544.
- Agarwal, N., Lamichhane, G., Gupta, R., Nolan, S. and Bishai, W. R. 2009. Cyclic AMPintoxication of macrophages by a Mycobacterium tuberculosis adenylate cyclase, Nature, 460 (7251), 98-102.
- Bell, C., Smith, G. T., Sweredoski, M. J. and Hess, S. 2012. Characterization of the Mycobacterium tuberculosis proteome by liquid chromatography mass spectrometry-based proteomics techniques: a comprehensive resource for tuberculosis research, Journal of Proteome Research, 11 (1), 119-130.
- Brosch, R., Gordon, S. and Eiglmeier, K. 2000. Genomics, Biology, and Evolution of the Mycobacterium tuberculosis Complex. In: Hatfull GF, Jacobs WR Jr; eds. Molecular Genetics of Mycobacteria. 1st ed. Washington, DC: ASM Press; 19-36.
- Brennan, P. 2003. Structure, function, and biogenesis of the cell wall of Mycobacterium tuberculosis. Tuberculosis (Edinb); 83: 91-7.
- Soulen, R., Byers, J., Osofsky, M., Nadgorny, B., Ambrose, T., Cheng, S., Broussard, P. R., Tanaka, C., Nowak, J. and Moodera, J. 1998. Measuring the spin polarization of a metal with a superconducting point contact. Science, 282(5386); 85-88.
- Ullrich, M. 2009. Bacterial polysaccharides: current innovations and future trends, Horizon Scientific Press.
- Ryll, R., Kumazawa, Y. and Yano, I. 2001. Immunological properties of trehalose dimycolate (cord factor) and other mycolic acid-containing glycolipids – a review. Microbiol Immunol; 45: 801-11.
- Smith, D., Harding, G., and Chan, J. 1979. Potency of 10 BCG vaccines as evaluated by their influence on the bacillemic phase of experimental airborne tuberculosis in guinea-pigs. J Biol Stand; 7:179-97.
- Verma, R., Lee, P., Lee, S., Springham, S. V., Tan, T., Rawat R. S., and Krishnan, M. 2008. Order of magnitude enhancement in neutron emission with deuterium-krypton admixture operation in miniature plasma focus device. Applied Physics Letters, 93(10); 101501.